Vydání 1/ 2025
VĚDA KRÁTCE
-
Zobrazení: 0

R.HONZÁK: DEPRESE A STŘEVNÍ MIKROBIOM; SOUČASNÉ POZNATKY
Epidemiologický odhad říká, že nejrůznějšími psychickými poruchami včetně závislostí trpí asi jedna miliarda lidí na planetě. Z toho více než třetina je obětí deprese. Depresivní symptomatologie je značně pestrá jak co do svých projevů a průběhu. Ale také co do své patogeneze a odezvy na léčbu. Společná je dysfunkce osy hypofýza-hypotalamus-nadledviny, imunitně zánětlivé změny, změněný tonus vagu, nerovnováha excitačních a inhibičních procesů a vyčerpání koncentrací monoaminů.
Chamtivost farmaceutických firem vedla k sjednocení všech podtypů do jedné velké depresivní poruchy (F32), která má být léčena především antidepresivy ovlivňující serotoninový systém, tedy primárně preparáty typu SSRI. Psychoterapie a všechny další postupy jsou pokládány za adjuvantní.  Toto sjednocení má za následek, že 20–60 % nemocných je rezistentních k uvedené léčbě (1). Deprese reaktivní a endogenní předchozí klasifikace vyžadují zásadně jiný přístup a je třeba vzít v úvahu, že svá specifika mají deprese při somatických onemocněních, především kardiovaskulárních a nádorových, deprese u diabetu, u endokrinních poruch, neurodegenerativních onemocněních, epigenetických vlivech a v poslední době i deprese související se střevní dysbiózou, o čemž svědčí také řada nepřímých důkazů dokládajících výskyt deprese a úzkostí po dlouhodobém užívání antibiotik. Z tohoto úhlu pohledu je možné rozšířit i nabídku terapeutických postupů (2).
Toto sjednocení má za následek, že 20–60 % nemocných je rezistentních k uvedené léčbě (1). Deprese reaktivní a endogenní předchozí klasifikace vyžadují zásadně jiný přístup a je třeba vzít v úvahu, že svá specifika mají deprese při somatických onemocněních, především kardiovaskulárních a nádorových, deprese u diabetu, u endokrinních poruch, neurodegenerativních onemocněních, epigenetických vlivech a v poslední době i deprese související se střevní dysbiózou, o čemž svědčí také řada nepřímých důkazů dokládajících výskyt deprese a úzkostí po dlouhodobém užívání antibiotik. Z tohoto úhlu pohledu je možné rozšířit i nabídku terapeutických postupů (2).
Tento přehled je zaměřen především na poslední z uvedených možností. Je třeba si uvědomit, že původní obousměrné spojení střevní – centrální mozek bylo poněkud zkomplikováno do podoby mikrobiom – střevo – mozek (MGB = microbiome – gut – brain). Úkoly mikrobiomu jsou četné: zpracování potravy, produkce některých potřebných molekul včetně neurotransmiterů, pomoc při imunitních reakcích, pomoc při bariérové funkci střevní stěny a další. Množství mikrobů (zejména bakterií) několikanásobně převyšuje počet buněk našeho organismu a pokud jde o genom, je převýšení řádově dvojnásobné. Z tohoto množství je obtížné vybrat bakterie, které se podílejí na regulaci naší emotivity. Zatím se jeví jako významné bakterie Faecalibacterium prausnitzi, Roseburia intestinalis a rody Ruminococcus, Coprococcus a Dialister. Jak dalece jejich podávání jako probiotik je užitečné, je však zatím sporné.
Buňky střevní výstelky jsou bohatým producentem serotoninu, který u myší působí antidepresivně, přestože neprojde hematoencefalickou bariérou, a dalších neurotransmiterů, složky imunity produkují prozánětlivé i protizánětlivé interleukiny. Bakterie produkují neurotransmitery a další metabolity, jejichž dostupnost je omezena mozkovou bariérou, jsou ale schopné (antidepresivní i depresogenní) ovlivňovat CNS paralelními cestami. Během deprese bylo zjištěno narušení běžných cest MGB. Vývoj prebiotik, probiotik a synbiotik vedl ke studiím, které zkoumaly nejen jejich dopad na mikrobiotu, ale také jejich terapeutickou hodnotu pro duševní zdraví. Tato psychobiotika mají potenciál být použita jako terapeutické doplňky při léčbě deprese. Pokud jde o budoucí směry a ve snaze dále porozumět úloze osy mikrobiota-střevo-mozek v depresi, bude zapotřebí více studií, jako jsou ty, které zahrnují transplantaci fekální mikrobioty prováděné zatím s dosti jednoznačnými výsledky na myším modelu přenosu deprese (2). Kromě nedávných zjištění se také naznačuje, že bude třeba provést další výzkum (3), aby se zjistilo, zda jsou specifické kmeny střevních organismů spojeny s depresí. (4, 5).
V poslední době se pozornost soustřeďuje také na kyselinu homovanilovou, která byla ve studii Zhao a kol. (7) sledována jak na myším modelu, tak u lidí. Autoři pozorovali ochuzené druhy střevních bakterií, včetně Bifidobacterium lon-gum a Roseburia intestinalis, a neurotransmiter homovanilovou kyselinu (HVA) u jedinců s modely deprese a myší deprese. Ačkoli R. intestinalis neprodukuje HVA přímo, zvyšuje hojnost B. longum, což vede k tvorbě HVA. To zdůrazňuje synergickou interakci mezi střevní mikrobiotou při regulaci produkce střevních neurotransmiterů.
Podávání HVA, B. longum nebo R. intestinalis myším modelům s chronickým nepředvídatelným mírným stresem (CUMS) a depresí vyvolanou kortikosteronem (CORT) významně zlepšilo depresivní příznaky. Mechanicky HVA inhibovala synaptickou autofagickou smrt tím, že zabránila nadměrné degradaci proteinu 1 spojeného s mikrotubuly lehkého řetězce 3 (LC3) a proteinů SQSTM1/p62, čímž chránila presynaptickou membránu hipokampálních neuronů. Tato zjištění podtrhují roli střevního mikrobiálního metabolismu při modulaci synaptické integrity a poskytují vhled do potenciálních nových strategií léčby deprese.
S ohledem na definitivní korelaci mezi střevním mikrobiomem, metabolomem a depresí autoři zkoumali kohorty skládající se ze 469 účastníků, včetně 262 jedinců s depresí a 207 zdravých kontrol. Vzorky séra byly odebrány od všech účastníků pro metabolický profil a vzorky stolice byly získány od podskupiny 129 účastníků (65 jedinců s depresí a 64 zdravých kontrol) pro analýzu střevní mikrobioty. Definice deprese u jedinců byla založena na skóre Hamiltonovy škály deprese (HAMD)-17. Ve střevním mikrobiálním složení byly pozorovány významné rozdíly mezi zdravými kontrolami a jedinci s depresí. Většina diferenciálních bakterií patřila ke čtyřem kmenům, Firmicutes, Proteobacteria, Bacteroidetes a Actinobacteria.
Autoři provedli také komplexní analýzu všech metabolitů, aby identifikovali rozdíly mezi těmito dvěma skupinami. Jejich zjištění odhalila významné rozdíly v několika neurotransmiterech a žlučových kyselinách, včetně kyseliny homovanilové (HVA), serotoninu, L-tryptofanu, L-tyrosinu, kyseliny glykoursodeoxycholové (GUDCA) a kyseliny chenodeoxycholové (CDCA).
Kyselina homovanilová (HVA) je fyziologicky neaktivní konečný metabolit dopaminu, který se nakonec vylučuje močí. Předchozí výzkumy HVA se primárně zaměřovaly na její fyziologické úrovně, spíše než její účinky na depresi. V této studii autoři identifikovali významné poruchy střevní mikrobioty jedinců s depresí, doprovázené poklesem HVA. Zjistili metabolickou souvislost mezi následujícími bakteriemi a HVA a zjistili, že B. longum může přímo produkovat HVA a R.intestinalis podporuje její růst. Důležité je, že HVA účinně zmírnila depresivní fenotypy u dvou myších modelů, což zdůrazňuje klíčovou roli osy střevo-mozek a interakce mikrobiálních metabolitů v léčbě deprese. Stručně řečeno, studie ukazuje, že HVA, produkovaná B. longum a obohacená smíšenými probiotiky obsahujícími mimo jiné R. intestinalis, účinně zmírňuje depresi a reguluje synaptickou integritu. Perorální suplementace HVA v kombinaci s míchaným probiotickým koktejlem vykazuje slibný terapeutický potenciál.
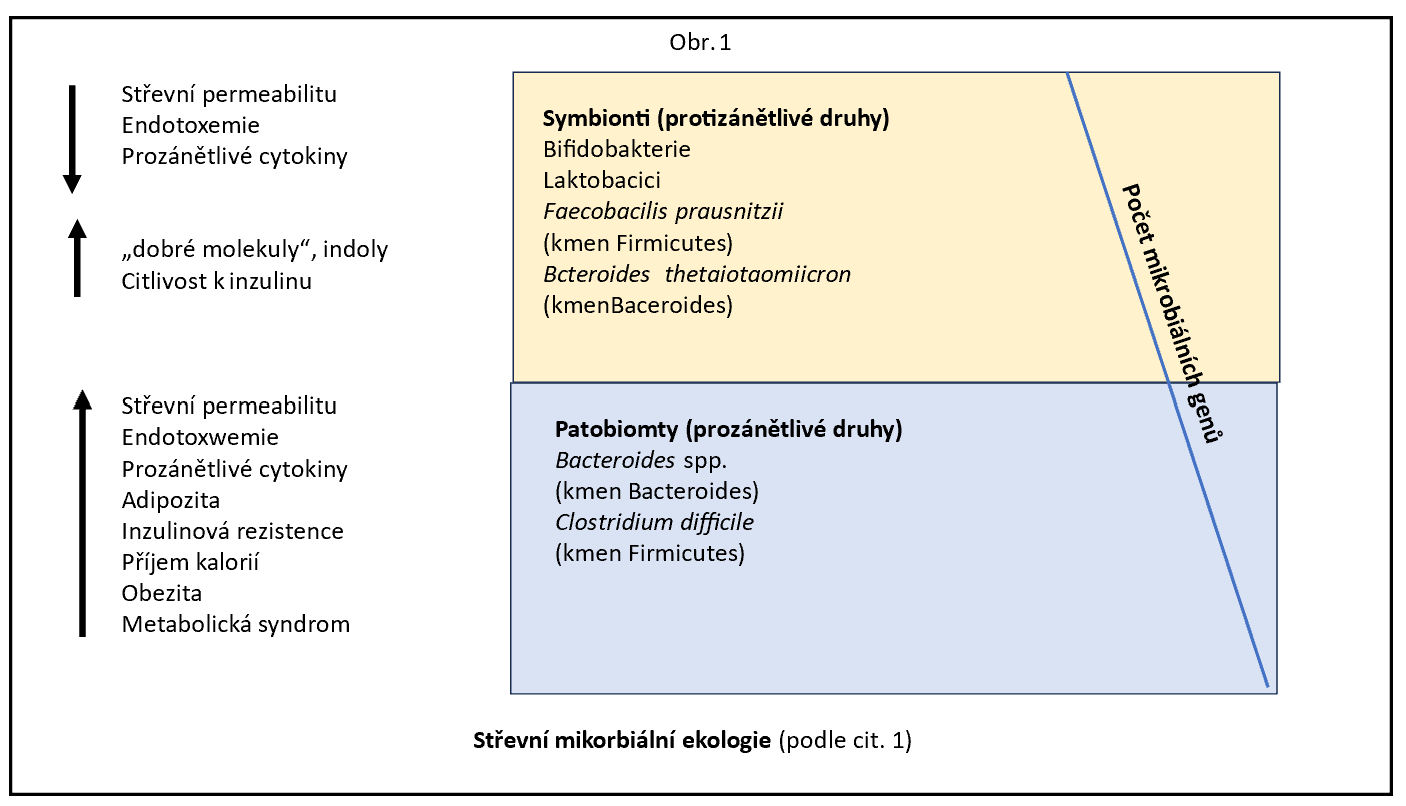
Zajímavým podtypem depresivní poruchy je „zánětlivá deprese“ značně rezistentní k léčbě, kdy změny ve střevním mikrobiomu jsou výrazné, nedávají ale jasnou kauzální odpověď. Nacházíme zánětlivé markery a mastné kyseliny s krátkými řetězci v plazmě. Střevní mikrobiota pacientů se zánětlivou depresí vykazuje vyšší množství Bacteroides a nižší Clostridium, s nárůstem druhů produkujících SCFA s abnormálním metabolismem butyrátů. Po provedené transplantaci fekální mikrobioty (FMT) a suplementaci probiotik v pokusech na zvířatech je možné uvažovat o roli střevní mikrobioty při zánětlivé depresi. Po FMT vykazuje střevní mikrobiota skupiny se zánětlivou depresí zvýšené periferní a centrální zánětlivé faktory a propustnost střevní sliznice u myší příjemců s depresivním a úzkostným chováním. Podávání Clostridium butyricum normalizuje střevní mikroflóru, snižuje zánětlivé faktory a vykazuje účinky podobné antidepresivům u myšího modelu zánětlivé deprese. Tato zjištění naznačují, že zánětlivé procesy odvozené ze střevní mikrobioty se mohou podílet na neurozánětu zánětlivé deprese.
Zánět v hipokampu – paměťovém centru mozku – významně mění motivaci a chování u myší, včetně chování při vyhledávání potravy, s pozoruhodnými rozdíly mezi samci a samicemi, odhaluje nedávná studie (8). Hipokampus hraje klíčovou roli při formování paměti, učení a emoční regulaci. Hipokampální neurozánět se vyskytuje u řady onemocnění a poruch, jako je Alzheimerova choroba, roztroušená skleróza a deprese. Lidé s těmito onemocněními často pociťují běžné příznaky, jako je apatie, potíže s každodenními činnostmi a změny stravovacích preferencí. Tyto příznaky mají také tendenci být závažnější u žen než u mužů.
I když zánět v hipokampu není zodpovědný přímo za změny chování, pravděpodobně spouští širší mozkovou aktivitu, která chování ovlivňuje. Tento výzkum naznačuje, že léčba zaměřená na hipokampální neurozánět by mohla pomoci snížit kognitivní a behaviorální symptomy u těchto poruch a zlepšit zdraví mozku, zejména u žen.
Navzdory těmto poznatkům je nutné přiznat, že jsme teprve na začátku cesty, která by měla být korunována plným porozuměním vzájemných souvislostí a možností terapeutického zásahu.
- Do redakce přišlo 24.12.2025
- K tisku zařazeno 1.1.2025
- Konflikt zájmů není znám.
ODKAZY:
- Howes OD, et al.: Treatment resistance in psychiatry. State of art and new directions. Mol Psychiatry, 2022;27:58-72. DOI: 10.1038/s41380-021-01200-3.
- Dinah TH, Cryan JF: Brain-Gut-Microbiota Axis and Mental Health. Psychosom Med. 2017 Oct;79(8):920-926. doi: 10.1097/PSY.0000000000000519.
- Gacias , et al: Microbiota-driven transcriptional changes in prefrontal cortex override genetic differences in social behavior. eLife, 2016; 5 DOI: 7554/eLife.13442.
- Jakob L, Höschl C: Mikrobiom a duševní zdraví. In Tlaskalová-Hogenová H, Eklová D a kol: Mikrobiom a zdraví. Grada, Praha, 2024, s. 151-159
- Halabitska I, et al.: The interplay of gut microbiota, obesity, and depression: insights and interventions. Mol. Life Sci. 81, 443 (2024). https://doi.org/10.1007/s00018-024-05476-w
- Zhao M, et al.: Gut bacteria-driven homovanillic acid alleviates depression by modulating synaptic integrity. Cell Metab. 2024 May 7;36(5):1000-1012.e6. doi: 10.1016/j.cmet.2024.03.010. Epub 2024 Apr 5.PMID: 38582087
- Liu P, et al: Immunoregulatory role of the gut microbiota in inflammatory depression. Nat Commun, 2024 Apr 8;15(1):3003. doi: 10.1038/s41467-024-47273-w.
- Ganesan K, etal: Hippocampal neuroinflammation induced by lipopolysaccharide causes sex-specific disruptions in action selection, food approach memories, and neuronal activation. Brain, Behavior, and Immunity, 2025; 124: 9 DOI: 1016/j.bbi.2024.11.011
Praha 21.12.2024 radkinh@seznam.cz





